光动力疗法(PDT)是临床获批的肿瘤治疗策略,其利用光照条件下光敏剂产生活性氧物种(ROS)杀死癌细胞。目前的研究主要集中在提高光敏剂的ROS产生能力,却忽视了代谢和清除途径这一重要的药物代谢动力学特性。对于小分子光敏剂,过快的血液清除以及过高的血管渗透,导致其肿瘤靶向效率低,抗癌疗效不佳;对于具有较大粒径(50-200 nm)的纳米光敏剂,虽然可以利用实体瘤的高通透性和滞留效应(EPR效应)来延长血液循环时间并提升肿瘤靶向能力,但是其会在肝脏和脾脏等器官中大量的积累且清除缓慢,造成潜在的器官毒性。因此,如何平衡光敏剂“靶向”和“清除”的对立关系仍面临一定挑战。到目前为止,兼具肿瘤靶向和肾脏清除能力的光敏剂鲜有报道。
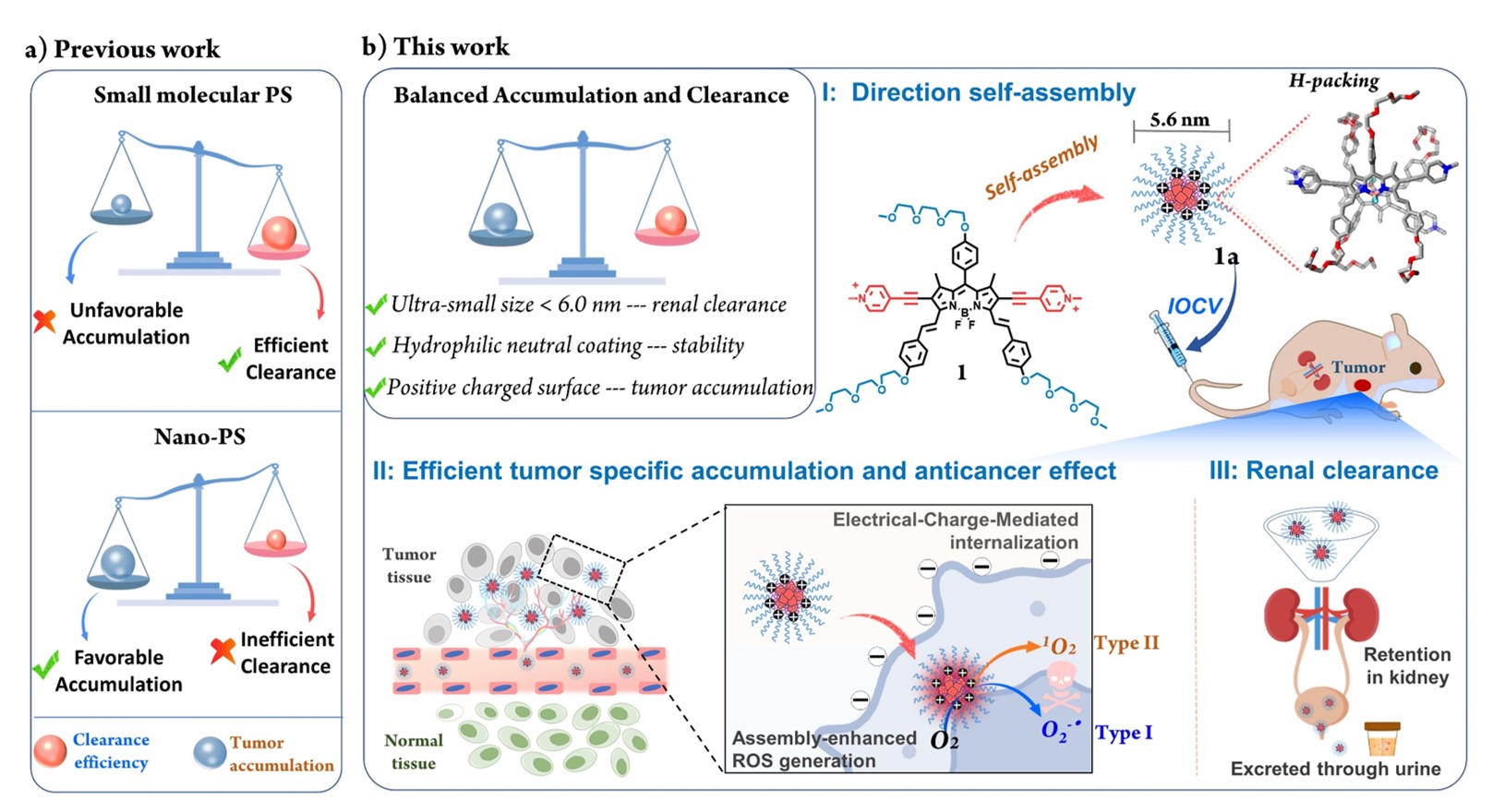
近日,金沙威尼斯欢乐娱人城杨清正教授、牛丽亚副教授课题组报道了一种肾脏可清除的纳米光敏剂用于高效肿瘤靶向光动力治疗。肾脏可清除的纳米药物能够经尿液以原形药物直接排出体外,无需经过缓慢的肝胆等器官代谢途径,从而避免了药物在体内的长期滞留带来的毒副作用。利用该光敏剂实现了高效肿瘤靶向富集以及治疗完成后快速的肾脏清除,兼顾了抗癌疗效和安全性。通过在BODIPY主体结构引入高亲水性TEG(二缩三乙二醇)链及双吡啶盐阳离子结构使该分子能够在水中自发组装,形成平均粒径为5.9 nm的超小纳米颗粒,小于肾脏滤过阈值(~ 6 nm),且TEG链在颗粒表面形成的空间位阻屏障能够减少血液循环过程中蛋白的吸附,避免被肝脏网状内皮系统识别摄取,实现高效的肾清除;双阳离子结构赋予了该纳米药物肿瘤特异性的细胞内化效应,实现快速高效的肿瘤靶向。此外,光敏剂分子的H聚集也促进了光敏剂的系间窜越效率,显著增强了纳米光敏剂的活性氧产生能力。抗肿瘤实验表明,该光敏剂在活细胞和小鼠模型中都表现出了优异的光动力效果,且没有明显的毒副作用。该工作为构建兼具肿瘤靶向和肾清除能力的光动力治疗敏化剂提供了新思路。
该工作得到了国家自然科学基金(22231001, 21971023, 22177014)的资助,同时也感谢中国科学院过程研究所赵鲁阳副研究员在分子动力学模拟方面的帮助。相关研究结果近期被《Advanced Materials》杂志接收发表,金沙威尼斯欢乐娱人城张东生博士(现入职河南师范大学化学化工学院)为文章第一作者,牛丽亚副教授和杨清正教授为通讯作者(Ultra-small Nano-assemblies as Tumor-targeted and Renal Clearable Theranostic Agent for Photodynamic Therapy. Adv. Mater. 2023, DOI: 10.1002/adma.202209789)。